政策法規 ||《化學仿制藥參比制劑目錄(第九十七批)》(征求意見稿)(附法規概覽8.25-8.29)
01
關于公開征求《化學仿制藥參比制劑目錄(第九十七批)》(征求意見稿)意見的通知

點擊下方鏈接
查看詳細信息
https://www.cde.org.cn/main/news/viewInfoCommon/3bd0e121d62b5ab0555b95ac58cc47f2
02
國家藥監局藥審中心關于發布《化學藥品仿制藥上市許可申請模塊二藥學資料撰寫要求(試行)》的通告(2025年第32號)

點擊下方鏈接
查看詳細信息
https://www.cde.org.cn/main/news/viewInfoCommon/8173832d915fc5c592ff840651f4bd38
01
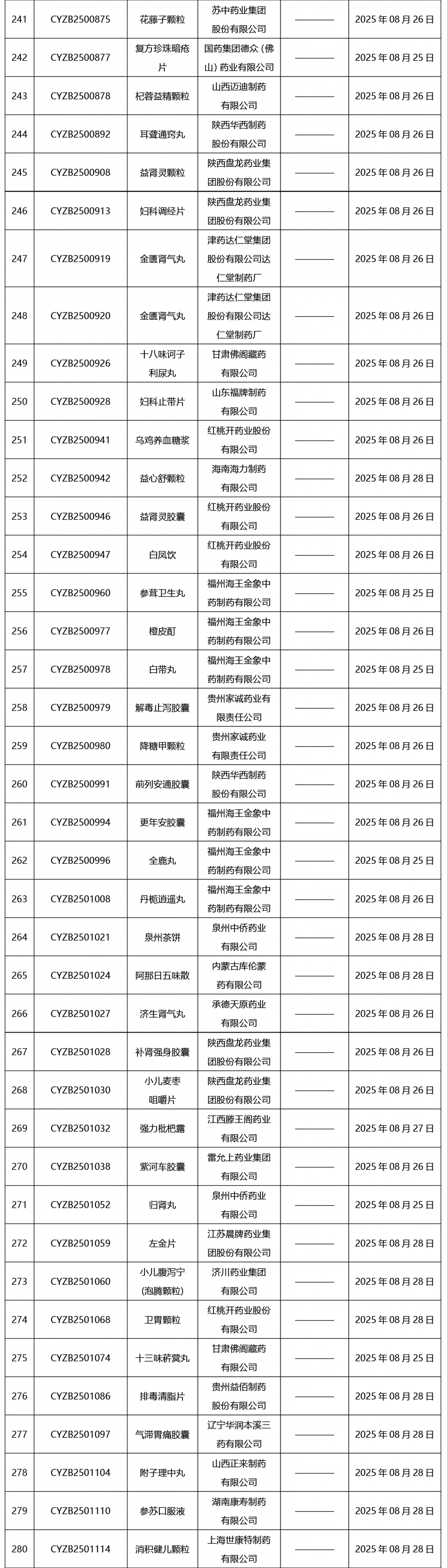
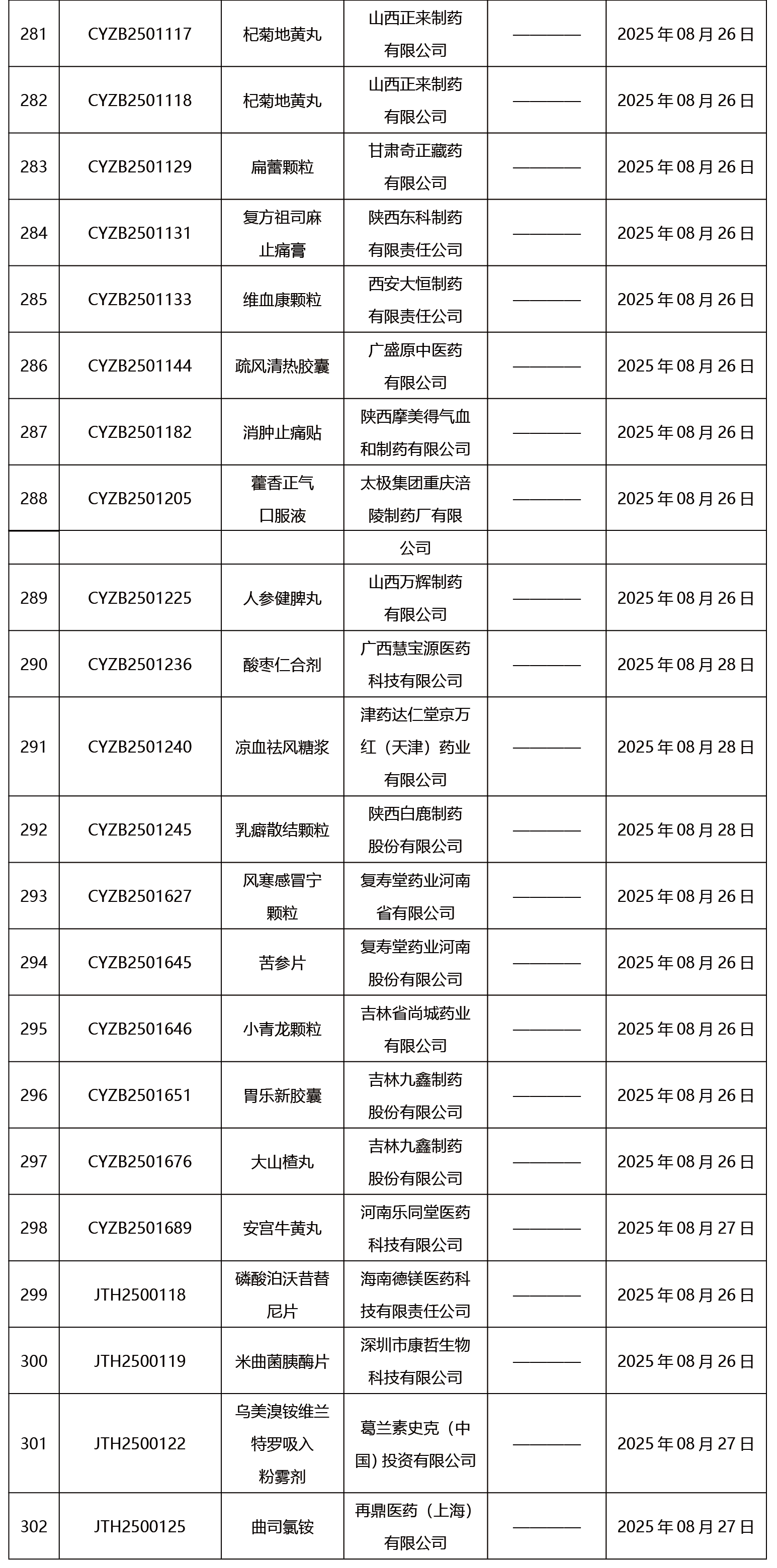
本周共發布302項藥品批準證明文件送達信息。

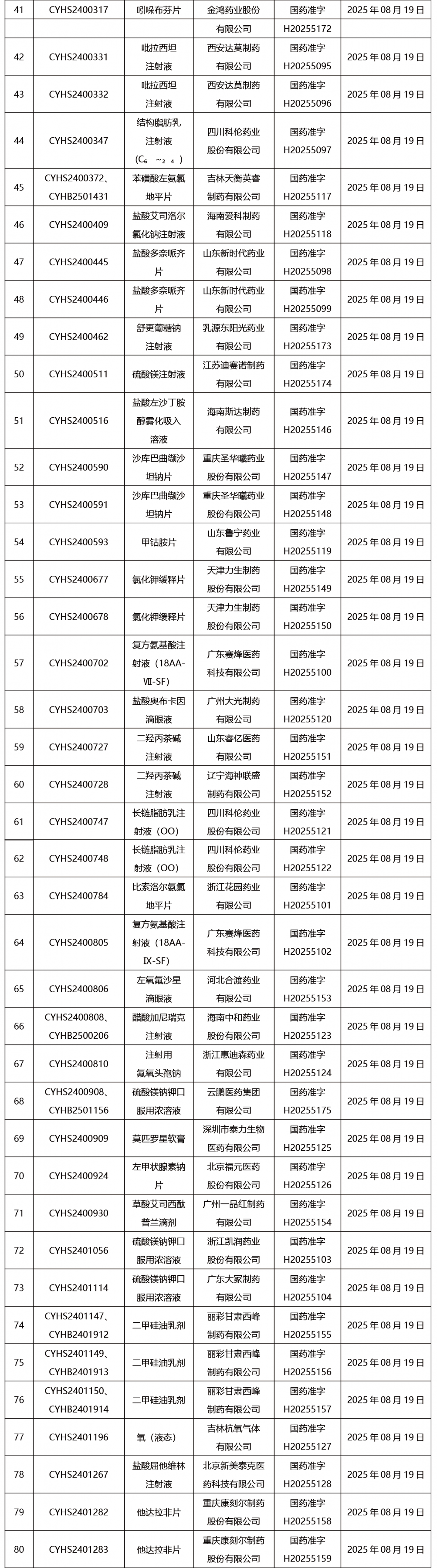
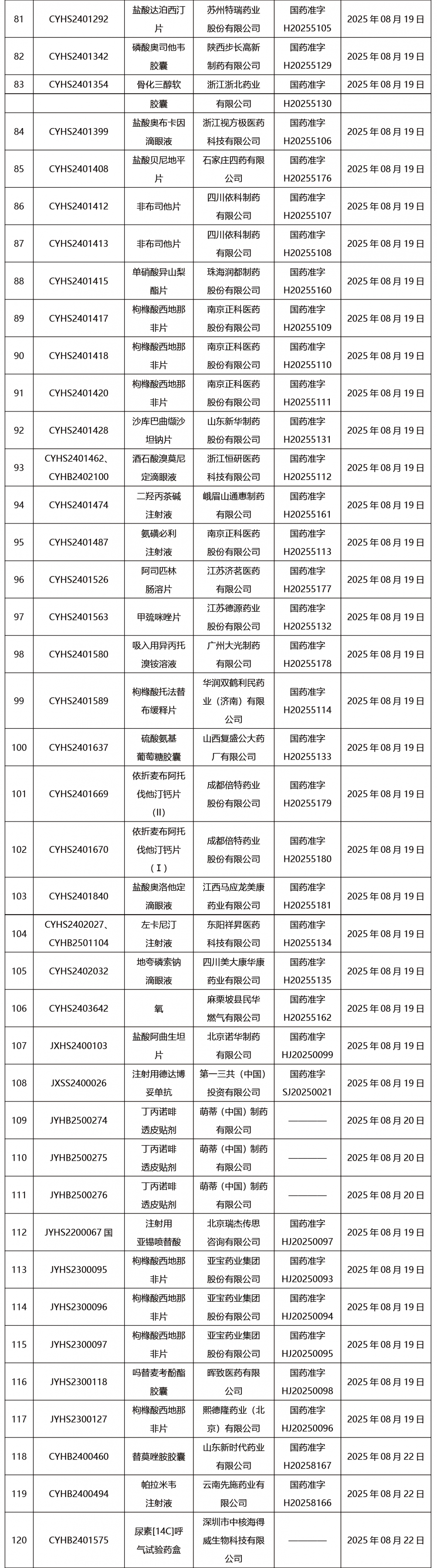
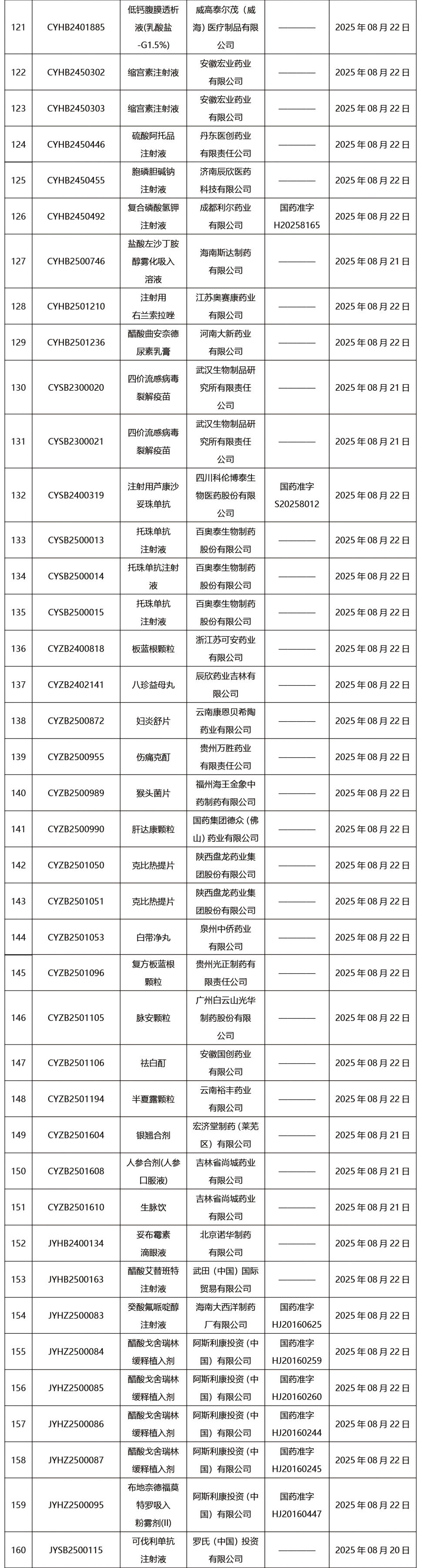
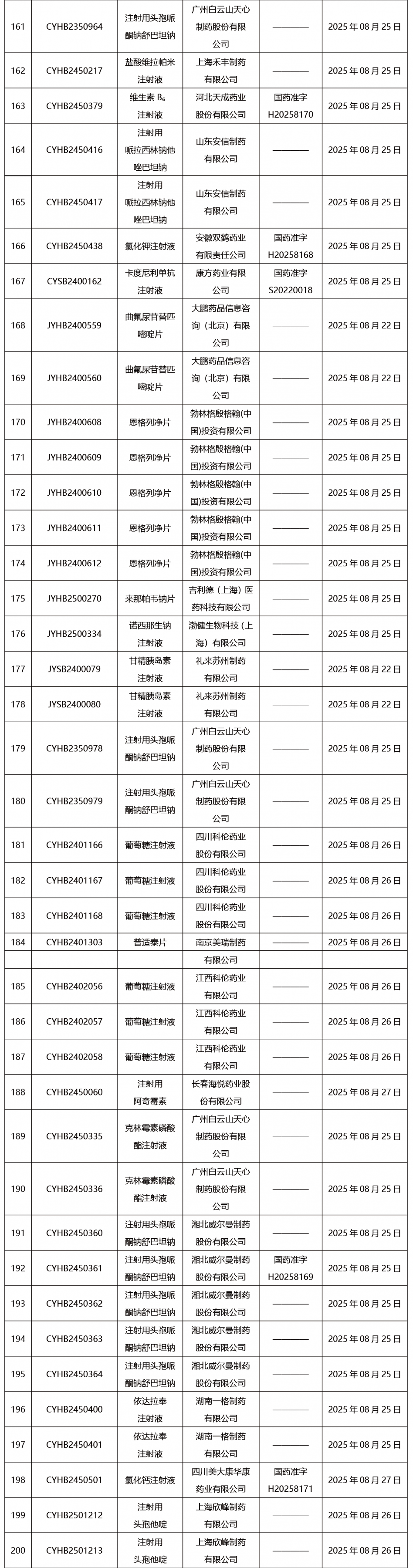

CDE
01
國家藥監局藥審中心關于發布《疫苗佐劑非臨床研究技術指導原則》的通告(2025年第36號)

點擊下方鏈接
查看詳細信息
https://www.cde.org.cn/main/news/viewInfoCommon/886af98cc4c51bc86e8ecb816ec634c5
02
關于公開征求《預防用生物制品批準后藥學變更管理方案技術指導原則(征求意見稿)》意見的通知

點擊下方鏈接
查看詳細信息
https://www.cde.org.cn/main/news/viewInfoCommon/f686913c23aedf3d126748ab13e1b9cf
03
關于公開征求ICH《E6(R3):藥物臨床試驗質量管理規范技術指導原則(GCP)》原則及附件1實施建議意見的通知

點擊下方鏈接
查看詳細信息
https://www.cde.org.cn/main/news/viewInfoCommon/aa3e4b17f74fd27f1589fbcbb3b93f64
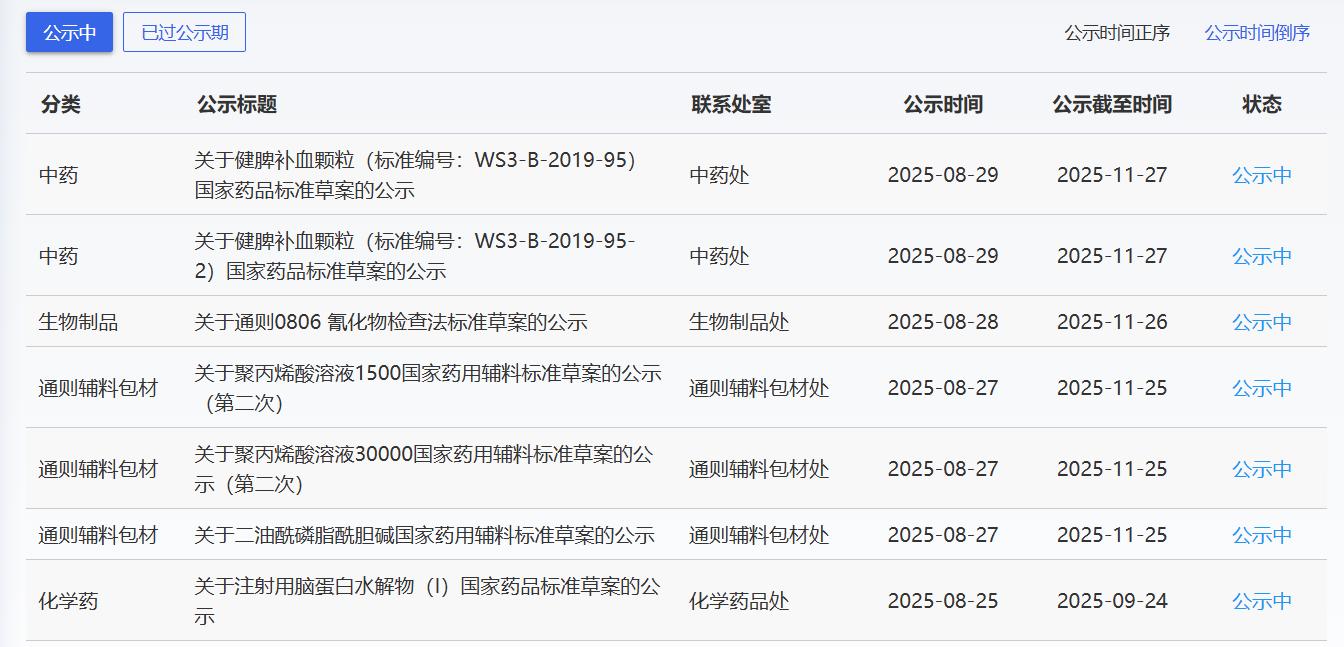
近期,藥典委發布的標準草案公示如下:
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-83057670
Hotline服務熱線:010-83057670
 簡體中文
簡體中文

 010-83057670
010-83057670 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
